|
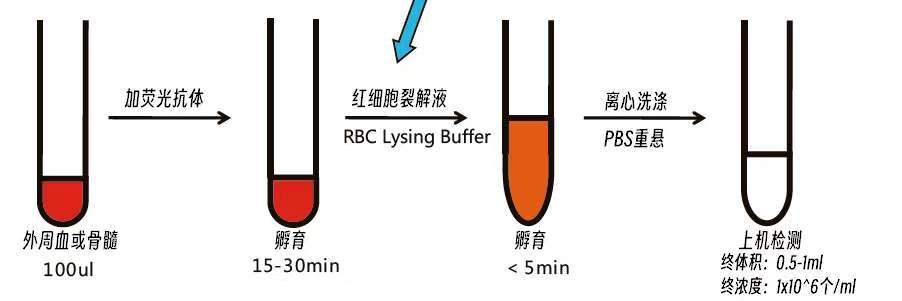
人人都是流式高手 | 流式细胞术样本制备全攻略!时间:2025-04-15 流式细胞分析的临床应用日益广泛,常用于淋巴细胞亚群分析、白血病免疫表型分析、肿瘤治疗中的方案选择及疗效评估等。检测的样本多为外周血、骨髓、各种体液(如脑脊液、胸水、腹水)及人体的组织(淋巴结、脾脏、肝)。制备出合格的分散单细胞将极大促进流式细胞分析的规范化和标准化工作。接下来为大家介绍流式各种样本制备的流程和关键注意事项,助您实验事半功倍! 一、外周血、骨髓样本制备 ① 样本采集与保存: 使用EDTA或肝素抗凝,12h内检测可室温保存,24-48h处理需4℃保存。 ② 红细胞裂解 取100-200μl抗凝全血/骨髓,加入2ml红细胞裂解液,轻柔混匀,外周血室温孵育裂解10min,骨髓裂解5-8min;特殊样本可增加稀释度或延长裂解时间,加入PBS至满管,300-400g离心5min,弃上清以终止裂解;重复PBS离心洗涤,去除碎片。 骨髓样本粘稠需用PBS稀释后再裂解;若红细胞残留,可重复裂解1次。 推荐使用商品化裂解液,不同品牌以具体说明书为准。 ③ 抗体染色 胞膜表面染色:根据Panel用量加入5-20 μl不同荧光素标记的抗体,避光室温孵育15min,PBS离心洗涤后,重悬于PBS中,若不及时检测,可加多聚甲醛固定后避光4 ℃保存,待上机检测。 胞内染色:按照不同厂家的说明书,先标记膜表面抗体,再添加破膜剂处理10min,后加入胞内抗体,避光室温孵育30min,洗涤后重悬。 ④ 注意事项: 荧光染色过程可以有不同的流程顺序:染色-裂解-洗涤,染色-裂解-免洗,裂解-染色-洗涤。不同的染色流程对流式样本的荧光强度有明显影响,根据多中心数据表明,染色后裂解继而洗涤,可以改善FSC、SSC的CV,得到最高的荧光强度。
二 组织样本制备 ① 样本采集: 新鲜组织样本置于生理盐水或PBS中,室温保存,尽量在12 h内处理样本;若无法及时处理,4℃保存,保存时间最好不要超过48 h。 ② 常用方法
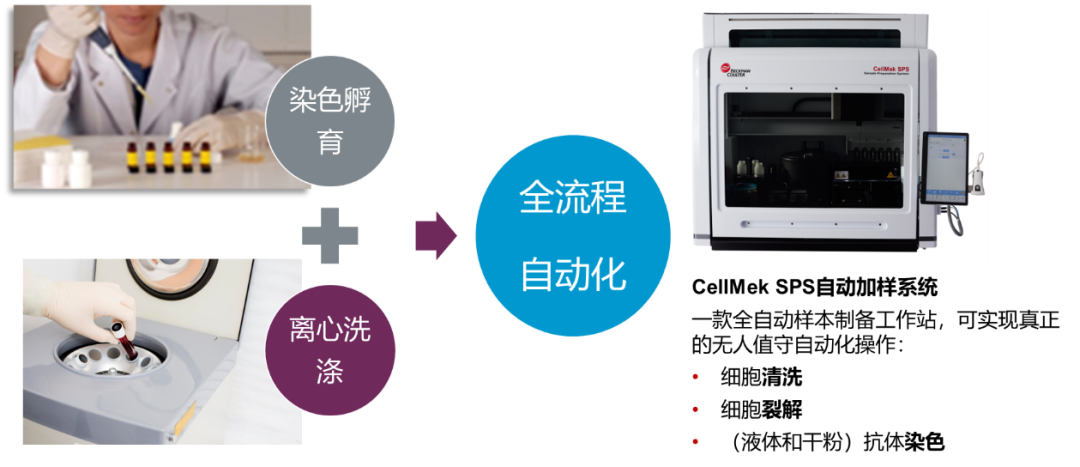
③ 注意事项: 不同组织样本根据不同检测项目要求需选用不同的处理方法。 酶处理注意时间、PH值、浓度等影响,且根据组织类型选择合适的酶。 三 体液样本制备 ① 样本采集与保存: 收集的样本至于肝素抗凝管,室温保存需12h内处理,若无法及时处理,4℃保存,保存时间最好不要超过48 h。 ② 制备方法: 体液样本离心5min,收集细胞沉淀,经PBS离心洗涤,若悬液有沉淀,可经200-300目滤网过来后再洗涤,最后用PBS调整至所需浓度备用。 ③ 注意事项: 脑脊液需高速离心浓缩细胞,胸腹水血性样本先裂解红细胞。 使用锥形底离心管,轻柔吹打以防细胞丢失。 随着技术发展,目前已经有自动化样本处理仪如贝克曼库尔特生命科学CellMek SPS应用于临床,这类仪器的使用会大大提高检测效率和分析精密度。各位感兴趣的小伙伴如需了解更多详细信息,欢迎联系贝克曼库尔特生命科学技术支持和业务代表获取详细资料。
|